Mabinline
Les mabinlines sont des protéines au goût sucré extraites de la graine du mabinlang, une plante venant du Yunnan.
Les mabinlines sont des protéines au goût sucré extraites de la graine du mabinlang (Capparis masaikai Levl. ), une plante venant du Yunnan (province de Chine).
Quatre protéines homologues ont été identifiées et appelées : mabinline-1, -2, -3 et -4. Mabinline-2 a été la première isolée en 1983[1] et caractérisée dix ans plus tard[2]. Les autres variantes, mabinline-1, -3 and -4 ont été découvertes et caractérisées en 1994[3].
Structure
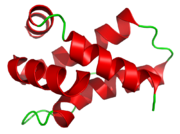
Les quatre protéines possèdent une structure tertiaire identique (2 chaînes reliées par des ponts disulfures) dont les séquences des acides aminés sont quasiment semblables.
Chaîne A M-1 : EPLCRRQFQQ HQHLRACQRY IRRRAQRGGL VD M-2 : QLWRCQRQFL QHQRLRACQR FIHRRAQFGG QPD M-3 : EPLCRRQFQQ HQHLRACQRY LRRRAQRGGL AD M-4 : EPLCRRQFQQ HQHLRACQRY LRRRAQRG Chaîne B M-1 : EQRGPALRLC CNQLRQVNKP CVCPVLRQAA HQQLYQGQIE GPRQVRQLFR AARNLPNICK IPAVGRCQFT RW M-2 : QPRRPALRQC CNQLRQVDRP CVCPVLRQAA QQVLQRQIIQ GPQQLRRLFD AARNLPNICN IPNIGACPFR AW M-3 : EQRGPALRLC CNQLRQVNKP CVCPVLRQAA HQQLYQGQIE GPRQVRRLFR AARNLPNICK IPAVGRCQFT RW M-4 : EQRGPALRLC CNQLRQVNKP CVCPVLRQAA HQQLYQGQIE GPRQVRRLFR AARNLPNICK IPAVGRCQFT RW
Séquence des acides aminés des protéines mabinlines (M) homologues, adapté de la base de données des protéines de Swiss-Prot[4], [5], [6], [7].
Les poids moléculaires respectifs de Mabinline-1, Mabinline-3 and Mabinline-4 sont 12, 3 kDa, 12, 3 kDa et 11, 9 kDa[3].
Avec un poids moléculaire de 10, 4 kDa, mabinline-2 est la plus légère. Sa structure tertiaire consiste en l'assemblage de 2 chaînes protéiques, A et B reliées par 2 ponts disulfures intermoléculaires. La chaîne A est constituée de 33 acides aminés et la chaîne B de 72[2], [8].
Cette protéine est la plus résistante à la chaleur comparée à ses 3 homologues mais également une des plus stables comparée aux autres protéines sucrantes connues[9], et ceci est dû à la présence de ponts disulfures[10].
Propriétés
La principale propriété des mabinlines est leur puissant goût sucré bien supérieur à celui du sucre. Elles sont aussi particulièrement stables à la chaleur.
Saveur sucrée
Le pouvoir sucrant de la mabinline-2 a été estimé à 100 (à poids égal) et 375 (à concentration égale[2]) soit nettement moins que la thaumatine mais avec un profil sucrant semblable[11]. Les mabinlines homologues (-1, -3 et -4) sont de pouvoir sucrant équivalent à la mabinline-2[3].
Stabilité à la chaleur
Le pouvoir sucrant de mabinline-2 reste inchangé après incubation à 100 °C pendant 48 heures[2].
Le pouvoir sucrant des mabinline-3 et -4 reste inchangé après incubation à 80 °C pendant une heure tandis que celui de mabinline-1 ne l'est plus dans les mêmes conditions[3], [12]. Selon l'étude menée par Y. Kurihara[3], les différences de stabilité à la chaleur seraient dues à la présence de l'arginine ou de la glutamine en position 47 sur la chaîne B.
Usage alimentaire
Mabinline-2 étant une protéine végétale naturelle, particulièrement soluble dans l'eau et résistante à la chaleur, a de forte chance de devenir un édulcorant naturel aussi répandu que la thaumatine. Cependant il n'existe pas encore de production industrielle de cette protéine.
Production
Durant la dernière décennie, des essais de production industrielle de la Mabinline-2 par génie génétique et synthèse ont été tentées.
En 1996, la protéine a été exprimée dans une pomme de terre transgénique, cependant aucun résultat n'a été toujours publié[13]. Cependant la même équipe a déposé un brevet protégeant la fabrication de la protéine par clonage et séquencement génétique en 2000[14].
En 1998 la protéine a été synthétisée, cependant le produit de synthèse était sucré et astringent[8].
Notes et références
- ↑ (en) Z Hu and M He, «Studies on mabinlin, a sweet protein from the seeds of Capparis masaikai levl. I. extraction, purification and certain characteristics», dans Acta Botan. Yunnan. , vol. 5, 1983, p. 207–212.
- (en) X Liu, S Mæda, Z Hu, T Aiuchi, K Nakaya & Y Kurihara, «Purification, complete amino acid sequence and structural characterization of the heat-stable sweet protein, mabinlin II», dans Eur J Biochem, vol. 211, 199, p. 281-287 [résumé, texte intégral lien DOI (pages consultées le 17/10/2008) ]. [pdf]
- (en) S Nirasawa, T Nishino, M Katahira, S Uesugi, Z Hu & Y Kurihara, «Structures of heat-stable and unstable homologues of the sweet protein mabinlin», dans Eur J Biochem, vol. 223, 1994, p. 989-995 [résumé, texte intégral lien DOI (pages consultées le 17/10/2008) ]. [pdf]
- ↑ (en) Mabinline-1 (2SS1_CAPMA - P80351) sur la base de données UniProtKB/Swiss-Prot
- ↑ (en) Mabinline-2 (2SS2_CAPMA - P30233) sur la base de donné UniProtKB/Swiss-Prot
- ↑ (en) Mabinline-3 (2SS3_CAPMA - P80352) sur la base de donné UniProtKB/Swiss-Prot
- ↑ (en) Mabinline-4 (2SS4_CAPMA - P80353) sur la base de donné UniProtKB/Swiss-Prot
- (en) M Kohmura & Y Ariyoshi, «Chemical synthesis and characterization of the sweet protein mabinlin II», dans Biopolymers, vol. 46, 1998, p. 215-223 [résumé lien DOI (pages consultées le 17/10/2008) ].
- ↑ (en) RJ Guan, JM Zheng, Z Hu & DC Wang, «Crystallization and preliminary X-ray analysis of the thermostable sweet protein mabinlin II», dans Acta Crystallogr D Biol Crystallogr, vol. 56, 2000, p. 918-919 [résumé (page consultée le 17/10/2008) ].
- ↑ (en) S Nirasawa, X Liu, T Nishino & Y Kurihara, «Disulfide bridge structure of the heat-stable sweet protein mabinlin II», dans Biochim Biophys Acta. , vol. 1202, 1993, p. 277-280 [résumé lien DOI (pages consultées le 14/10/2008) ].
- ↑ (en) Y Kurihara, «Characteristics of antisweet substances, sweet proteins, and sweetness-inducing proteins», dans Crit. Rev. Food Sci. Nutr. , vol. 32, 1992, p. 231-252 [résumé (page consultée le 17/10/2008) ].
- ↑ (ja) Y Kurihara & S Nirasawa, «Structures and activities of sweetness-inducing substances (miraculin, curculin, strogin) and the heat-stable sweet protein, mabinlin. », dans Foods and Food Ingredients Journal of Japan, vol. 174, 1997, p. 67-74. English Abstract (en)
- ↑ (en) LW Xiong & S Sun, «Molecular cloning and transgenic expression of the sweet protein mabinlin in potato tubers», dans Plant Physiology, vol. 111, 1996, p. 147.
- ↑ (en) S Sun, L Xiong, Z Hu & H Chen, «Recombinant Sweet protein Mabinlin. US PAT No. 6, 051, 758» sur http ://patft. uspto. gov, 2000, US Patent. Consulté le 17/10/2008.
Voir aussi
Recherche sur Google Images : |
|
"Mabinline - Wikipédia" L'image ci-contre est extraite du site fr.wikipedia.org Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (180 x 134 - 24 ko - png)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 05/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité