Exosome
L'exosome est un complexe protéique capable de dégrader les différents types de molécules d'ARN. On le trouve à la fois dans les cellules eucaryotes et les archées, alors que les bactéries ont un simple complexe nommé dégradosome qui exécute des fonctions identiques.
L'exosome est un complexe protéique capable de dégrader les différents types de molécules d'ARN (acide ribonucléique). On le trouve à la fois dans les cellules eucaryotes et les archées, alors que les bactéries ont un simple complexe nommé dégradosome qui exécute des fonctions identiques.
Le cœur du complexe est une structure circulaire constituée de six protéines sur lesquelles viennent se fixer d'autres protéines. Dans les cellules eucaryotes, l'exosome est présent dans le cytoplasme, le noyau et surtout le nucléole. Différentes protéines entrent en interaction avec le complexe dans ces différents compartiments pour réguler l'activité de dégradation de l'exosome sur des substrats spécifiques à ces compartiments cellulaires. Les substrats de l'exosome comprennent l'ARN messager, l'ARN ribosomique, ARN non codant, transcrits en fin de vie et de nombreuses espèces de petits ARN. L'exosome intervient aussi dans le Nonsense mediated decay ou NMD, un mécanisme de contrôle qualité qui assure la dégradation des ARNm comportant des codons stop prématurés.
La dégradation se fait principalement par coupure exonucléolytique, ce qui veut dire que l'exosome hydrolyse la chaîne d'ARN à partir d'une extrémité (l'extrémité 3'dans ce cas), plutôt que de cliver l'ARN à des sites internes.
Même si aucune relation de causalité entre le complexe et une maladie n'est connue, plusieurs protéines du complexe de l'exosome sont la cible d'anticorps spécifiques chez des patients atteints de maladies auto-immunes (surtout la scléromyosite) et certains médicaments utilisés dans les chimiothérapies anticancéreuses agissent en bloquant l'activité de ce complexe.
Découverte
L'exosome a été découvert pour la première fois comme RNase en 1997, sur des cultures de levures de Saccharomyces cerevisiæ, un organisme fréquemment utilisé comme modèle[1]. Peu de temps après, en 1999, on s'est aperçu que l'exosome était en fait l'équivalent chez la levure d'un complexe déjà découvert dans les cellules humaines, nommé le PM/Scl complex, qui avait été identifié comme un autoantigène chez des patients atteints de certaines maladies auto-immunes quelques années plus tôt (voir ci-dessous) [2]. La purification de cette substance a permis l'identification de la majorité des protéines de l'exosome humain et , finalement, la caractérisation de l'ensemble des composants du complexe. [3], [4]. En 2001, la quantité croissante de données génétiques devenues disponibles ont permis de prévoir l'existence de ces protéines chez les Archæa, mais il faudra toujours deux ans avant que le premier exosome d'archæa soit purifié. [5], [6].
Structure
Protéines du cœur
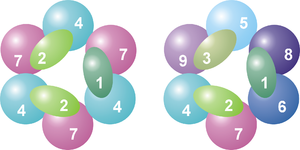
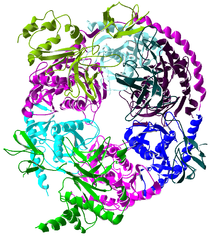
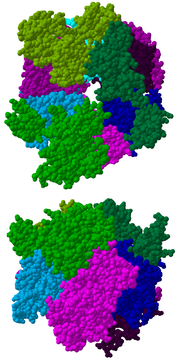
Le cœur du complexe a une structure d'anneau composé de six des protéines qui appartiennent toutes à la même classe de ribonucléases, les RNases PH[7]. Chez les Archæa, on trouve deux protéines RNases PH (appelées Rrp41 et Rrp42) présentes trois fois en alternance dans le cœur. Chez les Eucaryotes, on en trouve six différentes pour former la structure en anneau. [8], [9]. Sur ces six protéines des Eucaryotes, trois ressemblent à la protéine Rrp41 et les trois autres sont plus proches de la protéine Rrp42 des Archæa[10].
Sur le dessus de cet anneau se situent trois protéines qui ont un domaine de liaison à l'ARN (RNA binding domain ou RBD) de type S1. Deux de ces protéines ont, en outre, un domaine analogue à la protéine K (K-homology ou KH) [7]. Chez les Eucaryotes, les trois protéines liées à l'anneau sont différentes alors que chez les Archæa, il n'y a qu'un ou deux types de protéines faisant partie de l'exosome même s'il y a toujours trois protéines jointes au complexe[11].
.
Références
- ↑ Mitchell et al. , «The Exosome : A Conserved Eukaryotic RNA Processing Complex Containing Multiple 3′→5′ Exoribonucleases», dans Cell, vol. 91, no 4, 1997, p. 457–466 [lien PMID lien DOI]
- ↑ Allmang et al. , «The yeast exosome and human PM-Scl are related complexes of 3'→ 5'exonucleases», dans Genes and Development, vol. 13, no 16, 1999, p. 2148–58 [lien PMID lien DOI]
- ↑ Brouwer et al. , «Three novel components of the human exosome», dans Journal of Biological Chemistry, vol. 276, 2001, p. 6177–84 [lien PMID lien DOI]
- ↑ Chen et al. , «AU binding proteins recruit the exosome to degrade ARE-containing mRNAs», dans Cell, vol. 107, 2001, p. 451–64 [lien PMID lien DOI]
- ↑ Koonin et al. , «Prediction of the archæal exosome and its connections with the proteasome and the translation and transcription machineries by a comparative-genomic approach», dans Genome Research, vol. 11, no 2, 2001, p. 240–52 [lien PMID lien DOI]
- ↑ Evguenieva-Hackenberg et al. , «An exosome-like complex in Sulfolobus solfataricus», dans EMBO Reports , vol. 4, no 9, 2003, p. 889–93 [lien PMID lien DOI]
- Schilders et al. , «Cell and molecular biology of the exosome : how to make or break an RNA», dans Mondial review of cytology, vol. 251, 2006, p. 159–208 [lien PMID lien DOI]
- ↑ Lorentzen et al. , «The archæal exosome core is a hexameric ring structure with three catalytic subunits», dans Nature Structural & Molecular Biology, vol. 12, 2005, p. 575–81 [lien PMID lien DOI]
- ↑ Shen et al. , «A view to a kill : structure of the RNA exosome», dans Cell, vol. 127, 2006, p. 1093–5 [lien PMID lien DOI]
- ↑ Raijmakers et al. , «Protein-protein interactions between human exosome components support the assembly of RNase PH-type subunits into a six-membered PNPase-like ring», dans Journal of Molecular Biology, vol. 323, 2002, p. 653–63 [lien PMID lien DOI]
- ↑ Walter et al. , «Characterization of native and reconstituted exosome complexes from the hyperthermophilic archæon Sulfolobus solfataricus», dans Molecular Microbiology, vol. 62, 2006, p. 1076–89 [lien PMID lien DOI]
Pour approfondir
- Vanacova et al. , «The exosome and RNA quality control in the nucleus», dans EMBO reports, vol. 8, 2007, p. 651–657 [texte intégral lien DOI]
- Houseley et al. , «RNA-quality control by the exosome», dans Nature Reviews Molecular Cell Biology, vol. 7, 2006, p. 529–539 [texte intégral lien DOI] –-- souscription nécessaire
- Büttner et al. , «The exosome : a macromolecular cage for controlled RNA degradation», dans Molecular Microbiology, vol. 61, 2006, p. 1372–1379 [texte intégral lien DOI]
- Lorentzen et al. , «The Exosome and the Proteasome : Nano-Compartments for Degradation», dans Cell, vol. 125, 2006, p. 651–654 [lien DOI]
- G. J. M. Pruijn, «Doughnuts dealing with RNA», dans Nature Structural & Molecular Biology, vol. 12, 2005, p. 562–564 [texte intégral lien DOI]
Recherche sur Google Images : |
|
"Mechanism of exosome formation" L'image ci-contre est extraite du site dir.nhlbi.nih.gov Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (337 x 287 - 252 ko - png)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 05/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité